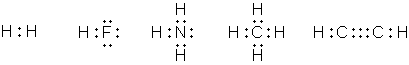|
Учебное пособие для студентов химфака РГУ
Делимость "неделимого" – Модели атома – Химическая связь – Квантовая химия Делимость "неделимого" Открытие делимости атома, ознаменовавшее собой конец господствовавшего в естествознании механистического атомизма, произошло на рубеже XX века. Это открытие имеет достаточно длинную предысторию. Уже в 1870-е годы, после создания периодического закона химических элементов, среди естествоиспытателей вновь возродился интерес к гипотезе Уильяма Праута (см. главу IV). Хотя точнейшие определения атомных весов и показали, что в ряде случаев их нецелочисленность нельзя объяснить ошибками опыта, гипотеза о протиле – некоей простейшей составной части атома вновь стала активно обсуждаться. Английский астрофизик Джозеф Норман Локьер, изучавший спектры звёзд и показавший, что они состоят в основном из водорода, выступил в 1873 г. с идеей эволюции элементов. Широкую известность получила книга "О происхождении химических элементов", которую написал в 1886 г. английский физик Уильям Крукс, крупный специалист в области спектрального анализа. Крукс полагал, что все элементы произошли из протила, каковым, по-видимому, является водород, "…путём эволюции, подобно тому, как произошли члены нашей солнечной системы согласно теории Лапласа, и как произошли растения и животные нашей планеты – по Ламарку, Дарвину и Уоллесу". У гипотезы об эволюции элементов было, впрочем, немало противников, указывавших, что эта гипотеза не имеет никаких экспериментальных оснований. Основной экспериментальной предпосылкой установления делимости атома стали исследования электрического тока, проводимые физиками на протяжении всего XIX века. В 1874 г. ирландский физик Джордж Джонстон Стоуни высказал идею о том, что электричество состоит из элементарных зарядов, связанных с атомами, и вычислил величину этого элементарного заряда; в 1891 г. Стоуни предложил для него термин электрон. Исследования электрических разрядов в разреженных газах и вакууме, которые начал в 1859 г. немецкий физик Юлиус Плюккер, привели к тому, что Вильгельм Гитторф и Уильям Крукс открыли в 1869-1875 гг. невидимые катодные лучи, распространяющиеся в вакууме от катода к аноду. Природа катодных лучей, которые распространяются прямолинейно и вызывают флюоресценцию (свечение) стекла вокруг анода, долгое время оставалась неизвестной; немецкие физики предполагали волновую, английские – корпускулярную природу катодных лучей. В 1886 г. немецкий физик Эуген Гольдштейн, экспериментируя с решетчатым катодом, открыл каналовые лучи, распространяющиеся противоположно катодным; была высказана гипотеза о том, что каналовые лучи состоят из положительно заряженных частиц. В 1895 г. французский физик Жан Батист Перрен обнаружил отклонение катодных лучей электрическим полем, доказав тем самым, что они представляют собой поток отрицательно заряженных частиц. Наконец, в 1897 г. немецкий физик Эмиль Вихерт и англичанин Джозеф Джон Томсон независимо друг от друга определили отношение заряда электрона к его массе, окончательно доказав его существование. Масса электрона, по данным Вихерта, составляла от 1/4000 до 1/2000 массы атома водорода; было замечено также, что масса электрона зависит от его скорости (точное значение заряда электрона определил в 1917 г. английский физик Роберт Эндрюс Милликен). Дж. Дж. Томсон сразу же высказал предположение о том, что электроны являются составной частью атома.
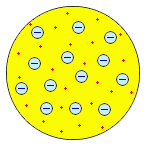
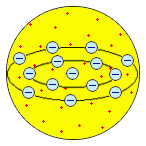
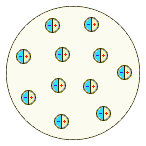
Изучение катодных лучей привело и к другому важному открытию. Вильгельм Конрад Рёнтген обнаружил в 1895 г., что при падении катодных лучей на антикатод возникает новый вид излучения – X-лучи (рентгеновские лучи), которые обладают высокой проникающей способностью и вызывают флюоресценцию различных веществ. Природа рентгеновских лучей также поначалу истолковывалась по-разному – помимо мнения, что X-лучи сходны с ультрафиолетом, высказывались и предположения об их корпускулярной природе. Окончательно волновая природа X-лучей была доказана лишь в 1913 г., когда Макс Теодор Феликс фон Лауэ обнаружил их дифракцию при прохождении через кристаллы (следствием этого открытия стало появление принципиально нового метода исследования – рентгеноструктурного анализа, позволяющего экспериментально определять молекулярную или кристаллическую структуру вещества). Пытаясь проверить высказанное французским математиком Анри Пуанкаре предположение о том, что X-лучи не связаны с катодными лучами, Антуан Анри Беккерель начал изучение флюоресценции солей урана. Беккерель опубликовал сообщение о том, что сульфат уранила после облучения солнечным светом даёт излучение, засвечивающее завёрнутую в чёрную бумагу фотопластинку. Однако уже через несколько дней Беккерель обнаружил, что соли урана вызывают почернение фотопластинок, даже не будучи облучёнными солнечным светом: они постоянно испускают проникающее излучение. Следует отметить, что о способности нитрата уранила разлагать соли серебра в темноте сообщал ещё в 1858 г. французский естествоиспытатель Ньепс де Сен-Виктор, однако его исследования в то время не вызвали интереса. В 1897-1898 гг. французские учёные Пьер Кюри и Мария Склодовская-Кюри установили, что испускание уранового излучения является свойством атома урана; это свойство не зависит от того, в каком соединении находится уран. В 1898 г. супруги Кюри обнаружили, что таким же свойством обладает и другой элемент – торий. В том же году они начали исследования богемской смоляной обманки – одного из природных минералов урана, испускающим более сильное излучение, чем чистые соли урана (супруги Кюри предложили новый термин – радиоактивность). Результатом их работы стало открытие двух новых радиоактивных элементов – полония и радия. В 1899 г. английский физик Эрнест Резерфорд обнаружил неоднородность уранового излучения: в магнитном поле лучи разделяются таким образом, что можно выделить две составляющих, соответствующих потокам частиц с положительными и отрицательными зарядами. Поль Виллар в 1900 г. выделил ещё один тип: лучи, не отклоняющиеся магнитным полем. Резерфорд предложил обозначать эти излучения первыми буквами греческого алфавита: альфа-, бета- и гамма-лучи. Беккерель показал, что β-лучи отклоняются магнитным полем в том же направлении и на ту же величину, что и катодные лучи, и, следовательно, представляют собой поток электронов. В 1900 г. Резерфорд установил, что соединения тория непрерывно выделяют радиоактивный газ – эманацию тория (радон), положив тем самым начало исследованиям продуктов радиоактивного распада. В 1903 г. Уильям Рамзай, первооткрыватель инертных газов, и Фредерик Содди доказали, что при α-распаде радия образуется гелий. В том же году Э. Резерфорд и Ф. Содди заложили основы теории радиоактивного распада, показав, что уран, торий и актиний являются родоначальниками семейств радиоактивных элементов, являющихся продуктами их распада; конечным продуктом распада является свинец. В качестве важнейшей характеристики радиоактивных элементов было предложено введённое П. Кюри понятие период полураспада. Исследования радиоактивности в корне изменили классическое понятие атома; стало очевидным, что атом надлежит понимать как сложную систему, в образовании которой участвуют некие более простые частицы. Хотя для химии установление делимости атома не привело к каким-либо принципиальным изменениям в теории, серьёзную проблему составляла необходимость размещения в периодической таблице элементов многочисленных продуктов радиоактивного распада, имеющих близкие атомные массы, но значительно отличающиеся периоды полураспада. С одной стороны, Теодор Сведберг в 1909 г. показал, что химически многие продукты радиоактивного распада тождественны. С другой стороны, было установлено, что атомные массы свинца и неона, полученных в результате радиоактивного распада, достоверно отличаются от атомных масс "обычных" элементов. Проблема была решена в 1913-1914 гг. Фредериком Содди. Химически неразличимые элементы, хотя бы и имеющие различные атомные массы – изотопы – Содди предложил размещать в одной ячейке периодической таблицы. Для определения места короткоживущих продуктов распада Содди предложил использовать закон сдвига, который одновременно с ним сформулировал в 1913 г. Казимир Фаянс. Согласно этому закону, продуктом α-распада является элемент, расположенный в периодической таблице на две клетки левее исходного, а продуктом β-распада – элемент, находящийся на одну клетку правее. Для обозначения атомов разных элементов, имеющих одинаковые массы, был предложен термин изобары. В 1914 г. в распоряжении физиков и химиков появился способ непосредственного определения положения элемента в периодической таблице – английский физик Генри Гвин Джефрис Мозли установил, что корень из частоты характеристического рентгеновского излучения находится в линейной зависимости от целочисленной величины – атомного номера, который совпадает с номером элемента в периодической таблице. Закон Мозли позволил экспериментально подтвердить правильность размещения элементов, в том числе и радиоактивных изотопов, в периодической таблице; подтвердилась также справедливость отступления в ряде случаев порядка элементов от порядка возрастания атомных масс (т.н. аномалии периодической таблицы). Именно атомный номер, совпадающий, как предположил голландский учёный Антониус ван ден Брук, с величиной положительного заряда ядра атома, стал основой классификации химических элементов. В 1920 г. английский физик Джеймс Чедвик экспериментально определил ядерные заряды меди серебра и платины, получив для них значения 29.3, 46.3 и 77.4 соответственно, что практически совпадало с их атомными номерами: 29, 47 и 78. К началу 20-х годов XX века изменилось само понятие химического элемента, берущее начало от Роберта Бойля. Вместо элемента как химически неразложимого вещества, состоящего из тождественных неделимых атомов, сформировалось представление об элементе как о совокупности атомов с одинаковым зарядом ядра. В 1919 г. Резерфорд осуществил первую искусственную ядерную реакцию, превратив азот в кислород бомбардировкой α-частицами, и экспериментально доказал существование протона; в 1920 г. он же высказал гипотезу о существовании нейтрона (который был экспериментально обнаружен Чедвиком в 1931 г.). Весьма примечательно, что название ядра простейшего атома – протон – созвучно праутовскому протилу. Открытие основных составных частей атома и возможности превращений элементов (оказалось, алхимики были не столь уж и не правы, говоря о том, что трансмутация – лишь вопрос искусства!) привело к коренному пересмотру представлений о строении вещества. Алхимический термин трансмутация возвратился в науку; теперь он стал означать превращение атомов одних химических элементов в другие в результате радиоактивного распада их ядер либо ядерных реакций. Первые модели строения атома появились в самом начале XX века. Жан Перрен в 1901 г. высказал предположение о ядерно-планетарном устройстве атома. Подобную же модель предложил в 1904 г. японский физик Хантаро Нагаока. В модели Нагаоки атом уподоблялся планете Сатурн; роль планеты выполнял положительно заряженный шар, представляющий собой основную часть объёма атома, а электроны располагались подобно спутникам Сатурна, образующим его кольца. Однако более широкое распространение получила т.н. кексовая модель атома: в 1902 г. Уильям Томсон (лорд Кельвин) высказал предположение о том, что атом представляет собой сгусток положительно заряженной материи, внутри которого равномерно распределены электроны. Простейший атом – атом водорода – представлял собой, по мнению У. Томсона, положительно заряженный шар, в центре которого находится электрон. Детально данную модель разработал Дж. Дж. Томсон, считавший, что электроны внутри положительно заряженного шара расположены в одной плоскости и образуют концентрические кольца. Дж. Дж. Томсон предложил способ определения числа электронов в атоме, основанный на рассеивании рентгеновских лучей в предположении, что именно электроны должны являться центрами рассеивания. Проведённые эксперименты показали, что количество электронов в атомах элементов равно приблизительно половине величины атомной массы. Дж. Дж. Томсон, предположив, что число электронов в атоме непрерывно возрастает при переходе от элемента к элементу, впервые попытался связать строение атомов с периодичностью свойств элементов. Немецкий физик Филипп фон Ленард попытался создать модель, не предполагающую раздельного существования в атоме противоположных зарядов. Атом, согласно модели Ленарда, состоит из нейтральных частиц (т.н. динамид), каждая из которых является электрическим дуплетом. Выполненные Ленардом расчёты показали, что эти частицы должны иметь крайне малые размеры, и, следовательно, большая часть объёма атома представляет собой пустоту. Сосредоточение массы атома в небольшой части его объёма отчасти подтверждалось и проведёнными Ленардом в 1903 г. опытами, в которых пучок быстрых электронов легко проходил через тонкую металлическую фольгу. Все упомянутые модели – Томсона – Томсона, Перрена – Нагаоки и Ленарда – являлись сугубо гипотетическими и исключительно качественными.
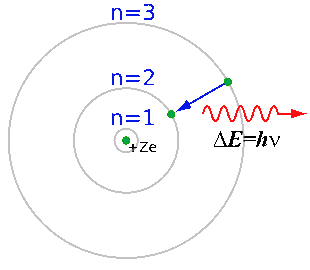
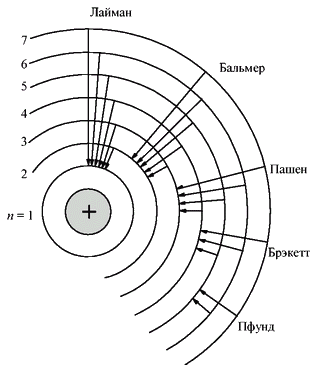
Результат опытов оказался совершенно противоположным ожидаемому. Большинство α-частиц проходило через золотую фольгу по прямым или почти прямым траекториям, но в то же время некоторые α-частицы отклонялись на очень большие углы, что свидетельствовало о наличии в атоме чрезвычайно плотного положительно заряженного образования. Основываясь на этих экспериментальных фактах, Резерфорд в 1911 г. предложил свою ядерную модель атома: в центре атома находится положительно заряженное ядро, объём которого ничтожно мал по сравнению с размерами атома; вокруг ядра вращаются электроны, число которых приблизительно равно половине атомной массы элемента. Модель атома Резерфорда при несомненных достоинствах содержала важное противоречие: в соответствии с законами классической электродинамики вращающийся вокруг ядра электрон должен был непрерывно испускать электромагнитное излучение, теряя энергию. Вследствие этого радиус орбиты электрона должен был быстро уменьшаться, и рассчитанное из этих представлений время жизни атома оказывалось ничтожно малым. Тем не менее, модель Резерфорда послужила основой для создания принципиально новой теории, которую разработал в 1913 г. датский физик Нильс Хенрик Давид Бор. Модель Бора опиралась на квантовую гипотезу, которую выдвинул в 1900 г. немецкий физик Макс Карл Эрнст Людвиг Планк. Планк постулировал, что вещество может испускать энергию излучения только конечными порциями, пропорциональными частоте этого излучения. Применив квантовую гипотезу для объяснения фотоэффекта, Альберт Эйнштейн в 1905 г. предложил фотонную теорию света. Ещё одной предпосылкой для боровской модели атома стали серии спектральных линий водорода, которые обнаружили в 1885 г. швейцарский ученый Иоганн Якоб Бальмер, в 1906 г. американский физик Теодор Лайман и в 1909 г. немецкий физик Фридрих Пашен. Эти серии (в видимой, ультрафиолетовой и инфракрасной областях спектра) подчинялись очень простой закономерности: частоты были пропорциональны разности обратных квадратов целых чисел. Бор объяснил устойчивость планетарной модели атома и одновременно эти спектральные данные с позиций квантовой теории, сформулировав ряд постулатов, накладывающих на модель атома квантовые ограничения. Согласно постулатам Бора, электрон может вращаться вокруг ядра лишь по некоторым дозволенным ("стационарным") орбитам, находясь на которых, он не излучает энергию. Ближайшая к ядру орбита соответствует "нормальному" (наиболее устойчивому) состоянию атома. При сообщении атому кванта энергии электрон переходит на более удалённую орбиту. Обратный переход из "возбуждённого" в "нормальное" состояние сопровождается испусканием кванта излучения.
Как показал расчёт на основании спектральных данных, радиусы электронных орбит относятся как 12 : 22 : 32 : … : n2. Иначе говоря, момент количества движения вращающегося электрона пропорционален целочисленному главному квантовому числу (номеру орбиты). Максимально возможное число электронов на каждом уровне равно удвоенному квадрату главного квантового числа; это число оказалось равным количеству элементов в периодах периодической таблицы. Модель Бора, таким образом, выявила несомненную связь периодичности свойств элементов со строением электронных оболочек атомов. Для атома водорода расчёты спектров на основе модели Бора дали хорошее согласие с экспериментом, но для других элементов получалось существенное расхождение с опытными данными. В 1916 г. немецкий физик Арнольд Иоганн Вильгельм Зоммерфельд уточнил модель Бора. Зоммерфельд высказал предположение, что кроме круговых, электрон может двигаться и по эллиптическим орбитам. При этом почти одинаковому уровню энергии соответствует число типов орбит, равное главному квантовому числу. Зоммерфельд дополнил модель побочным (орбитальным) квантовым числом (определяющим форму эллипсов) и зависимостью массы электрона от скорости. Основываясь на модели атома Бора-Зоммерфельда, представляющей собой компромисс между классическими и квантовыми представлениями (в классическую картину вводились квантовые ограничения), Нильс Бор в 1921 г. заложил основы формальной теории периодической системы. Причина периодичности свойств элементов, по мнению Бора, заключалась в периодическом повторении строения внешнего электронного уровня атома. В первой половине 1920-х гг. в модель атома были добавлены ещё два квантовых числа. Немецкий физик Альфред Ланде ввёл для описания движения электрона в атоме магнитное квантовое число, а молодые физики Джордж Юджин Уленбек и Сэмюэл Абрахам Гаудсмит в 1925 г. ввели в атомную физику представление о спине электрона, Следует отметить, что американский физик Артур Холли Комптон, основываясь на атомных спектрах высокого разрешения, ещё в 1921 г. высказывал предположение о квантованном вращении электрона, а в следующем году Отто Штерн и Вальтер Герлах экспериментально наблюдали разделение пучка атомов серебра в магнитном поле на две части, соответствующие ориентации электронных спинов. В 1925 г. Вольфганг Паули опубликовал свою работу, содержащую формулировку принципа запрета, носящего его имя: в данном квантовом состоянии может находиться только один электрон. Паули указал, что для характеристики состояния электрона необходимо четыре квантовых числа: главное квантовое число n, азимутальное квантовое число l и два магнитных числа m1 и m2. В 1927 г. немецкий физик Фридрих Хунд сформулировал эмпирические правила заполнения электронных оболочек. С применением запрета Паули и принципа насыщения уровней к 1927 г. была в целом построена электронная структура всех известных к тому времени 92 элементов. Создание учения о строении электронных оболочек атомов позволило разработать формальную физическую теорию периодической системы, объяснившую причины периодичности свойств элементов и их соединений, а также создать первые теории химической связи. Представления о природе химической связи На протяжении всего XIX века химия, основанная на атомно-молекулярной теории, не могла дать никаких объяснений природе связи между атомами. Понятие валентности, при всей плодотворности его применения, оставалось сугубо эмпирическим. Лишь после открытия делимости атома и установления природы электрона как составной части атома возникли реальные предпосылки для разработки первых теорий химической связи. Немецкие учёные Рихард Вильгельм Генрих Абегг и Гвидо Бодлендер в 1899 г. высказали идею о сродстве атомов к электрону – способности атомов присоединять электрон: "Вследствие того, что для существования неорганических соединений сродство атомов или отдельных групп к электрическому заряду оказывается гораздо более важным, нежели сродство их друг к другу, кажется вполне целесообразным принять за основу систематики неорганических веществ именно это сродство элементов и радикалов к электричеству...". На основе этих представлений Абегг в 1904 г. разработал теорию электровалентности. Валентностью, по мнению Абегга, обладают ионы, и величина валентности равна заряду иона. Каждый элемент характеризуется двумя максимальными валентностями – положительной и отрицательной, сумма которых равна восьми. Одна из них, производящая более сильное действие, нормальная, другая – контрвалентность. Для семи групп периодической системы Абегг приводил следующие значения нормальных и контрвалентностей:
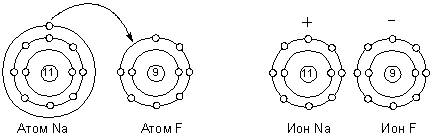
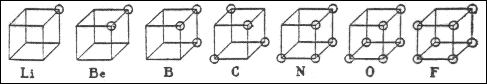
Следует отметить, что формулы высших оксидов и водородных соединений, приводимые Менделеевым в своей таблице, аналогичны построениям Абегга. Все дальнейшие попытки объяснения природы валентных сил находились в тесной связи с представлениями о строении атома. Дж. Дж. Томсон в своей модели строения атома указывал на участие электронов в образовании связи между атомами. В 1908 г. Уильям Рамзай высказал идею о связи атомов посредством общего электрона. Нильс Бор в 1913 г. предложил динамическую модель молекулы, в которой химическая связь возникает за счёт электронов, находящихся на общей для двух атомов орбите, плоскость которой перпендикулярна линии, соединяющей ядра. Иоганнес Штарк в 1915 г. ввёл в теорию понятие о валентных электронах: согласно Штарку, валентность атома не связана с общим числом электронов в атоме, а определяется только числом поверхностных электронов. Представления Штарка о валентных электронах и модель атома Резерфорда – Бора легли в основу новых теорий химической связи. Представления об электровалентности или полярной валентности получили развитие в работах немецкого физика Вальтера Косселя. В 1916 г. он разработал теорию гетерополярной (ионной) связи, основанную на модели атома Бора и представлении об особой стабильности двух- или восьмиэлектронных оболочек инертных газов. Реакционная способность атома, по Косселю, определяется его стремлением приобрести такую электронную конфигурацию. Учитывая тот факт, что большинство неорганических соединений полярно и способно диссоциировать на ионы, он предположил, что природа валентных сил заключается в электростатическом притяжении ионов, образующихся за счёт отдачи одним атомов одного или нескольких электронов другому. Ниже приведена схема образования молекулы фторида натрия по Косселю: В 1916 г. американский химик Джилберт Ньютон Льюис предложил теорию кубического атома, основанную на сходных предпосылках. Согласно Льюису, химическая инертность элементов нулевой группы периодической системы объясняется тем, что группы из двух или восьми электронов являются очень устойчивыми. По мнению Льюиса, атом гелия имеет два электрона; атом неона – два электрона, расположенных внутри куба, образованного восемью электронами. В аргоне ещё восемь электронов расположены в вершинах куба, внешнего по отношению к кубу неона. Атомы других элементам стремятся к приобретению или отдаче электронов, чтобы приобрести электронную конфигурацию инертного газа. Образование связи между одинаковыми атомами Льюис объяснил возможностью обобществления валентных электронов. Льюис предложил также способ изображения связей, в котором каждый валентный электрон обозначается точкой (формулы Льюиса).
Аналогичные взгляды высказал Ирвинг Ленгмюр, который, однако, отбросил идею о стационарном кубическом расположении внешних электронов в атоме. Ленгмюр предположил существование трёх типов валентности: положительной, отрицательной и ковалентности. Положительная и отрицательная валентности определяются числом электронов, которые атом способен соответственно отдать или принять. Ковалентность, по Ленгмюру, определяется числом электронных пар, которыми атом может владеть совместно с другими атомами. В начале 1920-х гг. английский химик Невилл Винсент Сиджвик распространил понятие ковалентности на неорганические и координационные соединения, постулировав существование похожего типа связи, в котором оба электрона связывающей электронной пары изначально принадлежали одному из соединяющихся атомов (семиполярная или донорно-акцепторная связь). В целом можно отметить, что теории Косселя и Льюиса – Ленгмюра позволили весьма удачно объяснить, как образуются химические связи между атомами в неорганических и органических соединениях. Основанные на "полуклассической" модели атома Бора – Зоммерфельда, теории ионной и ковалентной связи удачно сочетали простоту и наглядность с новейшими современными представлениями о строении атома. Опираясь на теории Косселя и Льюиса – Ленгмюра, в 1923 г. датский химик Йоханнес Николаус Брёнстед и англичанин Томас Мартин Лаури разработали протонную теории кислот и оснований, а Джилберт Льюис расширил представления о кислотах и основаниях, предложив электронную теорию, согласно которой кислота кислота является акцептором, а основание – донором электронных пар. Однако многие вопросы по-прежнему оставались без ответов. Теория Льюиса – Ленгмюра не могла объяснить причины связующего действия электронной пары; помимо этого, имелось множество отклонений от правила октета. Окончательное установление природы связи между атомами оказалось возможным лишь на основании принципиально новых – квантовомеханических – представлений. Для того, чтобы объяснить устойчивость атома, Нильс Бор соединил в своей модели классические и квантовые представления о движении электрона. Однако искусственность такого соединения была очевидна с самого начала. Развитие квантовой теории привело к изменению классических представлений о структуре материи, движении, причинности, пространстве, времени и т.д., что способствовало коренному преобразованию картины мира. В конце 20-х – начале 30-х годов XX века на основе квантовой теории сформировались принципиально новые теории строения атома и образования химической связи. После создания Альбертом Эйнштейном фотонной теории света (1905) и выведения им статистических законов электронных переходов в атоме (1917) в физике обострилась проблема "волна – частица". Если в XVIII–XIX веках имелись расхождения между различными учёными, которые для объяснения одних и тех же явлений в оптике привлекали либо волновую, либо корпускулярную теорию, то теперь противоречие приобрело принципиальный характер: одни явления (дифракция) интерпретировались с волновых позиций, а другие (фотоэффект) – с корпускулярных.
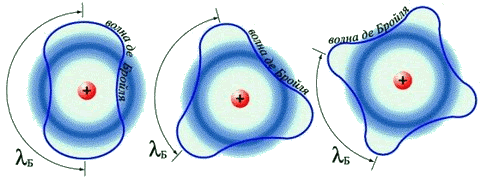
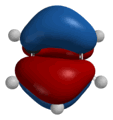
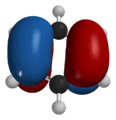
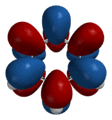
Разрешение этого противоречия предложил в 1924 г. французский физик Луи Виктор Пьер Раймон де Бройль, приписавший волновые свойства частице. Распространив идею о двойственной природе света на вещество, де Бройль предположил наличие у материальных частиц волновых свойств, однозначно связанных с массой и энергией. Он показал, что движению электрона может соответствовать некоторая волна материи, так же как движению светового кванта соответствует световая волна. Де Бройль предложил объяснить квантовые условия теории Бора с помощью представления о волнах материи. Волна, движущаяся вокруг ядра атома, по геометрическим соображениям может быть только стационарной волной; длина орбиты должна быть кратной целому числу длин волн. Гипотеза де Бройля о наличии у электронов волновых свойств была подтверждена обнаруженным в 1927 г. явлением дифракции электронов: оказалось, что пучок электронов дает дифракционную картину (позже будет обнаружена дифракция атомов и молекул). Исходя из идеи де Бройля о волнах материи, австрийский физик Эрвин Шрёдингер в 1926 г. вывел основное уравнение т.н. волновой механики, содержащее волновую функцию и позволяющее определить возможные состояния квантовой системы и их изменение во времени. Шредингер дал общее правило преобразования классических уравнений в волновые. В рамках волновой механики атом можно было представить в виде ядра, окруженного стационарной волной материи. Волновая функция определяла плотность вероятности нахождения электрона в данной точке. В том же 1926 г. немецкий физик Вернер Гейзенберг разработал свой вариант квантовой теории атома в виде матричной механики, отталкиваясь при этом от сформулированного Бором принципа соответствия. Согласно принципу соответствия, законы квантовой физики должны переходить в классические законы, когда квантовая дискретность стремится к нулю при увеличении квантового числа). В более общем виде принцип соответствия можно сформулировать следующим образом: новая теория, которая претендует на более широкую область применимости по сравнению со старой, должна включать в себя последнюю как частный случай. Квантовая механика Гейзенберга позволяла объяснить существование стационарных квантованных энергетических состояний и рассчитать энергетические уровни различных систем. Результаты, к которым приводили методы, используемые в волновой механике Шрёдингера и матричной механике Гейзенберга, оказались одинаковыми, поэтому обе концепции и входят в единую квантовую теорию как эквивалентные. Однако изначально волновая и матричная механики имели принципиальные различия в подходах. У Шрёдингера частица выступала как чисто волновое образование, т.е. частица есть место волны, в котором сосредоточена наибольшая энергия волны. Интерпретация Шрёдингера представляла собой, по сути, попытку создать более или менее наглядные модели в духе классической физики. Гейзенберг же сформулировал принцип неопределённости, в соответствии с которым точность определения координаты частицы обратно пропорциональна точности определения её скорости. Принцип неопределённости указывает на то, что частицы могут вести себя как волны – они как бы "размазаны" в пространстве, поэтому можно говорить не об их точных координатах, а лишь о вероятности их обнаружения в определённом пространстве. Таким образом, квантовая механика фиксирует корпускулярно-волновой дуализм – в одних случаях удобнее частицы считать волнами, в других, наоборот, волны частицами. С принципом неопределённости поначалу соглашались далеко не все физики; его всеобщему признанию предшествовала довольно длительная дискуссия. Осуществлённая Гейзенбергом и развитая Бором интерпретация квантовой теории получила название копенгагенской. В рамках данной интерпретации основным положением квантовой теории выступает принцип дополнительности, означающий требование применять для получения целостной картины изучаемого объекта взаимоисключающие классы понятий, приборов и исследовательских процедур, которые используются в своих специфических условиях и взаимно дополняют друг друга. Принцип дополнительности, таким образом, позволил дополнить классические теории квантовыми, а не противопоставить их друг другу. Вскоре после того, как Гейзенберг и Шрёдингер разработали квантовую механику, Поль Адриен Морис Дирак предложил более общую теорию, в которой элементы специальной теории относительности Эйнштейна сочетались с волновым уравнением. Уравнение Дирака применимо к частицам, движущимся с произвольными скоростями. Спин и магнитные свойства электрона следовали из теории Дирака без каких бы то ни было дополнительных предположений. Кроме того, теория Дирака предсказывала существование античастиц, таких, как позитрон и антипротон, – двойников частиц с противоположными по знак электрическими зарядами. Квантово-механический подход к строению атома привёл к созданию принципиально новых представлений о природе химической связи. Уже в 1927 г. Вальтер Гейтлер и Фриц Лондон начали разрабатывать квантовомеханическую теорию химической связи и выполнили приближённый расчёт молекулы водорода. Распространение метода Гейтлера – Лондона на многоатомные молекулы привело к созданию метода валентных связей, который разработали в 1928-1931 гг. Лайнус Карл Полинг и Джон Кларк Слэтер. Основная идея этого метода заключается в предположении, что атомные орбитали сохраняют при образовании молекулы известную индивидуальность. В 1928 г. Полинг предложил теорию резонанса и идею гибридизации атомных орбиталей, в 1932 г. – новое количественное понятие электроотрицательности и шкалу электроотрицательностей, выразил зависимость между электротрицательностью и энергией химической связи. Фридрих Хунд, Роберт Сандерсон Малликен и Джон Эдвард Леннард-Джонс в 1929 г. начали разработку метода молекулярных орбиталей. В основу ММО заложено представление о полной потере индивидуальности атомов, соединившихся в молекулу. Молекула, таким образом, состоит не из атомов, а представляет собой новую систему, образованную несколькими атомными ядрами и движущимися в их поле электронами. Фридрих Хунд предложил также современную классификацию химических связей; в 1931 г. он пришёл к выводу о существовании двух основных типов химических связей – простой, или σ-связи, и π-связи. В том же году немецкий физик Эрих Хюккель распространил метод МО на органические соединения, сформулировав правило ароматической стабильности (4n+2), устанавливающее принадлежность вещества к ароматическому ряду.
Таким образом, в квантовой химии сразу выделились два различных подхода к пониманию химической связи: метод молекулярных орбиталей и метод валентных связей. Сравнивая эти два метода, нетрудно заметить известные аналогии с теориями структурной химии XIX века – различия этих методов напоминают различия между новой теорией типов и теорией валентности. ММО, как некогда новая теория типов, рассматривает молекулу как принципиально новое, единое образование; МВС, подобно теории валентности, в значительной степени представляет собой аддитивный подход. Поскольку квантово-механическая модель атома оказалась куда менее наглядной, чем классическая, метод ВС как представление, которое, сохранив наглядность, не слишком противоречило истине, получил (особенно поначалу) более широкое распространение. Однако, несмотря на различия в подходах, оба метода приводят к практически одинаковым результатам. Благодаря квантовой механике к 30-м годам XX века в основном был выяснен способ образования связи между атомами (что, кстати говоря, являлось труднейшим вопросом атомизма, начиная от Левкиппа и Демокрита). Кроме того, в рамках квантово-механического подхода получило корректную физическую интерпретацию менделеевское учение о периодичности. |
|||||||||||||||||||||||