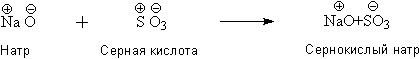|
Учебное пособие для студентов химфака РГУ
Стехиометрия – Атомистическая теория Дальтона – Проблема определения атомных масс – Электрохимические теории сродства Стехиометрия Блестящие успехи количественных методов исследования вещества, сделавшие возможной химическую революцию, уже в начале XIX века привели к новому фундаментальному изменению в естествознании вообще и в химии в частности. За открытым Лавуазье законом сохранения массы последовал целый ряд новых количественных закономерностей – стехиометрические законы. Первым стехиометрическим законом стал закон эквивалентов, который сформулировал немецкий химик Иеремия Вениамин Рихтер в результате проведённых им в 1791-1798 гг. опытов по изучению количеств вещества в реакциях нейтрализации и обмена, обобщённых в работе "Начальные основания стехиометрии или искусства измерения химических элементов". Первоначальная формулировка закона эквивалентов (термин "эквивалент" ввёл в 1767 г. Г. Кавендиш) была следующей: "Если одно и то же количество какой-либо кислоты нейтрализуется различными количествами двух оснований, то эти количества эквивалентны и нейтрализуются одинаковым количеством любой другой кислоты". Открытый Рихтером закон подтвердил убеждения многих химиков в том, что химические соединения взаимодействуют не в произвольных, а в строго определённых количественных соотношениях. Однако за этим последовала длительная дискуссия о том, присуща ли такая определённость всем без исключения химическим процессам. Основным предметом дискуссии стал вопрос о том, является ли постоянным соотношение элементов в соединении, состоящем из двух или более элементов, или же состав зависит от способа получения вещества. Клод Луи Бертолле, предложивший в 1803 г. теорию химического сродства, обусловленного силами притяжения и зависящего от плотности вещества и его количества, отстаивал предположение о том, что элементный состав вещества может изменяться в некоторых пределах в зависимости от условий, в которых оно было получено (термин избирательное сродство ввёл в 17 70-е гг. Торберн Улаф Бергман для объяснения реакционной способности веществ). Противоположных взглядов придерживался французский химик Жозеф Луи Пруст. С помощью тщательных анализов в 1799-1806 гг. он установил, что отношение количеств элементов в составе соединения всегда постоянно. Выводы Бертолле, как показал Пруст, были ошибочны из-за неточности анализов и недостаточной чистоты исходных веществ. Дискуссия двух учёных, продолжавшаяся с 1801 по 1808 г., завершилась блестящей победой Пруста. Закон постоянства состава (постоянных отношений) в итоге не просто был признан большинством химиков, но стал одним из главных химических законов. Тем не менее вопрос о причинах постоянства состава оставался открытым, поскольку из чисто аналитической концепции химического элемента это никоим образом не следует. Разрешить существующие сомнения могло лишь предположение о дискретности материи, однако атомистические взгляды по-прежнему не имели прямых экспериментальных доказательств. Атомистическая теория Дальтона Экспериментальное подтверждение атомной гипотезы нашёл английский химик Джон Дальтон. В начале XIX века Дальтон открыл несколько новых эмпирических закономерностей: закон парциальных давлений (закон Дальтона), закон растворимости газов в жидкостях (закон Генри-Дальтона) и, наконец, закон кратных отношений. Объяснить эти закономерности (прежде всего закон кратных отношений), не прибегая к предположению о дискретности материи, невозможно. Основываясь на законе кратных отношений, открытом в 1803 г., и законе постоянства состава, Дальтон разработал свою атомно-молекулярную теорию, изложенную в вышедшем в 1808 г. труде "Новая система химической философии". Основные положения теории Дальтона состояли в следующем: 1. Все вещества состоят из большого числа атомов (простых или сложных). 2. Атомы одного вещества полностью тождественны. Простые атомы абсолютно неизменны и неделимы. 3. Атомы различных элементов способны соединяться между собой в определённых соотношениях. 4. Важнейшим свойством атомов является атомный вес. Уже в 1803 г. в лабораторном журнале Дальтона появилась первая таблица относительных атомных весов некоторых элементов и соединений; в качестве точки отсчёта Дальтон выбрал атомный вес водорода, принятый равным единице. Для обозначения атомов элементов Дальтон использовал символы в виде окружностей с различными фигурами внутри. Впоследствии Дальтон неоднократно корректировал атомные веса элементов, однако для большинства элементов им приводились неверные значения атомных весов.
Таблица Дальтона стала первым шагом на долгом пути, который предстояло пройти химии для того, чтобы величины атомных масс приняли привычные для нас значения. Разрешение проблемы определения атомных весов, потребовавшее усилий многих выдающихся учёных, заняло более пятидесяти лет! И даже после того, как проблема была в основном решена, точное определение атомным масс оставалось настолько важной задачей, что в 1914 г. американский учёный Теодор Ричардс был удостоен Нобелевской премии за уточнение атомных масс некоторых элементов. Проблема определения атомных масс Главное затруднение при определении атомной массы состоит в том, что необходимо установить число атомов каждого элемента, входящее в состав соединения. Дальтон был вынужден сделать допущение о том, что атомы разных элементов при образовании сложных атомов соединяются по "принципу максимальной простоты". Суть принципа заключается в следующем: если имеется лишь одно бинарное соединение двух элементов, то его молекула (сложный атом) образована одним атомом одного элемента и одним атомом другого (сложный атом является двойным в терминологии Дальтона). Тройные и более сложные атомы образуются лишь в том случае, когда имеются несколько соединений, образованных двумя элементами. Отсюда Дальтон предполагал, что молекула воды состоит из одного атома кислорода и одного атома водорода. Результатом являлось заниженное значение атомного веса кислорода, что вело, в свою очередь, к неправильному определению атомных весов металлов на основании состава оксидов. Принцип наибольшей простоты (подкреплённый авторитетом Дальтона как создателя атомно-молекулярной теории) сыграл в дальнейшем определённую негативную роль при решении проблемы атомных весов. Однако в целом атомистическая теория Дальтона составила основу всего дальнейшего развития естествознания. Решению проблемы атомных весов способствовало открытие ещё целого ряда стехиометрических законов. Закон объёмных отношений (закон соединения газов) открыл французский химик Жозеф Луи Гей-Люссак. В 1808 г. он показал, что газы всегда соединяются в простых объёмных соотношениях. Амедео Авогадро ди Кваренья выдвинул в 1811 г. предположение, получившее название гипотезы (закона) Авогадро: "Равные объёмы газов при одинаковых давлении и температуре содержат одинаковое число молекул, так что плотность газов служит мерой массы их молекул и отношение объёмов при соединении суть не что иное, как отношение между числом молекул, соединяющихся между собой при образовании сложной молекулы". При выводе своего закона Авогадро использовал закон Гей-Люссака и результаты исследования электролиза воды, которое провели в 1800 г. два английских химика – Уильям Николсон и Энтони Карлайл. Николсон и Карлайл обнаружили, что объёмы выделяющихся при электролизе водорода и кислорода относятся как 2:1. Следствием из гипотезы Авогадро являлось предположение о том, что газообразные водород, кислород, азот и хлор состоят из двухатомных молекул; однако этот вывод вызвал резкие возражения. Предположение о том, что корпускулы элементарных субстанций являются сложными, казалось химикам противоречащим здравому смыслу. Молекулярная гипотеза Авогадро не была принята большинством физиков и химиков 1-й половины XIX в., которые не смогли отчётливо понять различия между атомом и молекулой. Тем не менее, в середине XIX века метод определения молекулярных масс по плотности паров получил широкое распространение. Изучив составленные Дальтоном таблицы атомных весов, английский химик Уильям Праут высказал в 1815-1816 гг. предположение о том, что атомные веса всех элементов должны быть целочисленны и кратны атомному весу водорода. Причина этого, по мнению Праута, состоит в том, что именно водород – основа всех остальных элементов (протил, своего рода аналог первичной материи античных философов). Впрочем, эта точка зрения, известная как гипотеза Праута, хотя и произвела значительное впечатление на современников, не получила широкого признания вследствие явных противоречий с опытными данными. Закон удельных теплоёмкостей открыли в 1819 г. французские учёные Пьер Луи Дюлонг и Алексис Терез Пти. Дюлонг и Пти показали, что удельная теплоёмкость твёрдых элементов (точнее говоря, простых веществ в твёрдом состоянии) обратно пропорциональна атомному весу; метод Дюлонга-Пти, позволял, таким образом, определять атомные веса некоторых элементов. Немецкий химик Эйльгард Мичерлих в 1819 г. нашёл, что соединения, образованные одинаковым количеством атомов, обладают одинаковой кристаллической формой и способны образовывать смешанные кристаллы. Закон изоморфизма Мичерлиха позволил экспериментаторам делать выводы о числе атомов, образующих молекулу соединения и, следовательно, определять атомные массы элементов. Огромный вклад в развитие химической атомистики и в решение проблемы атомных весов внёс шведский химик Йёнс Якоб Берцелиус. С 1807 г. он занялся систематическим изучением элементного состава соединений, представив огромное количество доказательств в пользу закона постоянства состава. В 1814 г. Берцелиус опубликовал первую таблицу атомных весов, в которой были приведены атомные веса 41 элемента (для составления таблицы Берцелиусу потребовалось определить состав почти 2 000 соединений!). В основу своей шкалы атомных весов Берцелиус положил атомный вес кислорода, принятый равным 100. Для определения атомных весов Берцелиус также был вынужден сделать ряд допущений (в частности, сильные основания должны были иметь состав RO2), в результате чего атомные веса ряда элементов были определены неверно. В 1814 г. Берцелиус подробно изложил также систему химических знаков, основанную на обозначении элементов одной или двумя буквами латинского названия элемента; число атомов элемента предлагалось указывать надстрочными цифровыми индексами (принятое в настоящее время указание числа атомов подстрочными цифрами предложил в 1834 г. Юстус Либих). Система химических знаков Берцелиуса, альтернативная крайне неудобной системе Дальтона, получила всеобщее признание и сохранилась до настоящего времени. В дальнейшем Берцелиус продолжал работы по уточнению и исправлению атомных весов элементов, используя для этой цели законы Мичерлиха, Гей-Люссака, Дюлонга и Пти (не воспользовавшись, однако, гипотезой Авогадро; Берцелиус считал, что в равных объёмах газов содержится одинаковое число атомов.). Новые, всё более точные таблицы атомных весов Берцелиуса выходят в 1818 и 1826 годах. В последней таблице значительные ошибки имеют место лишь для атомных весов некоторых металлов. Сводная
таблица атомных весов
Путанице в химической теории способствовало и учение об эквивалентах, которое развивал английский учёный Уильям Гайд Волластон. В работе "Синоптическая шкала химических эквивалентов" (1814) Волластон привёл таблицу эквивалентных масс элементов, которые большей частью совпадали с величинами атомных весов по Дальтону. Однако Волластон противопоставлял понятие "эквивалент" дальтоновскому понятию "атом". Многим химикам эквивалентные (соединительные) веса, казались более удобными и точными, чем атомные, поскольку они рассчитываются без принятых Дальтоном допущений. В 30-е годы XIX века учение об эквивалентах получило поддержку со сторону физиков – Майкл Фарадей открыл законы электролиза и экспериментально установил значения электрохимических эквивалентов. В результате широчайшего распространения "Руководства по теоретической химии" (1817-1819), которое написал немецкий учёный Леопольд Гмелин, учение о соединительных весах получило почти всеобщее признание среди химиков-неоргаников. Гмелин принимал атомную массу кислорода равной 8, а не 16, как у Берцелиуса; "исправлению" подверглись и атомные массы ряда других элементов. Печальным следствием стал тот факт, что, например, для уксусной кислоты химиками в 30-50-е годы XIX века предлагалось 19 различных брутто-формул! Попытки чётко разделить понятия предприняли в 40-е годы химики-органики. Шарль Жерар и Огюст Лоран развили идеи Авогадро, настаивая на необходимости установления чёткого различия между понятиями "атом", "молекула" и эквивалент". Окончательную ясность в атомно-молекулярную теорию внёс Международный конгресс химиков, собравшийся 3 сентября 1860 года в Карлсруэ. Новую систему понятий, основанную на идеях Авогадро, изложил в своём докладе итальянский химик Станислао Канниццаро. Конгресс в Карлсруэ ознаменовал долгожданное решение проблемы атомных весов, чётко разграничив понятия "атом", "молекула" и "эквивалент"; понятие "эквивалент" было решено считать чисто эмпирическим и не зависящим от понятий "атом" и "молекула". Определения атомных масс химических элементов, которые выполнил в первой половине 1860-х годов бельгийских химик Жан Серве Стас, до конца XIX века считались наиболее точными. Реформа Канниццаро завершила период, основным содержанием которого явилось установление количественных законов. Решения конгресса в Карлсруэ оказали большое влияние на дальнейшее развитие химии, сделав возможными последовавшие вскоре систематизацию химических элементов и создание периодического учения. Электрохимические теории сродства Создание Дальтоном атомной теории вновь поставило "проклятый вопрос атомизма" – вопрос о способе соединения атомов. Алессандро Вольта в 1800 г. представил доказательство несомненной связи между химическими реакциями и электричеством в виде первой электрической батареи ("Вольтов столб"). Последовавшие за этим блестящие успехи применения электричества в химии (разложение воды, выделение щелочных и щелочноземельных металлов) способствовали всеобщему убеждению естествоиспытателей в том, что силы, соединяющие атомы, должны иметь электрическую природу. Первую электрохимическую теорию химического сродства предложил в 1807 г. английский учёный Гэмфри Дэви. Основные идеи теории состояли в следующем: 1. Атомы, способные соединяться химически, приобретают при контакте противоположные заряды; 2. Акт химической реакции представляет собой соединение атомов за счёт сил электростатического притяжения, при котором происходит компенсация зарядов; 3. Химическое сродство атомов пропорционально их полярности (величине возникающего заряда). 4. Если подействовать на соединение электричеством, атомы восстанавливают полярность и движутся к электродам. Развивая представления Дэви, Й. Я. Берцелиус разработал в 1811-1818 гг. собственную электрохимическую теорию сродства. На основании изучения продуктов разложения солей, кислот и оснований, выделяющихся на электродах, Берцелиус создал весьма простую и наглядную дуалистическую систему: 1. Все атомы (простые и сложные) электрически заряжены и биполярны; при этом один из зарядов преобладает; 2. Соединение атомов сопровождается частичной нейтрализацией их зарядов; 3. При пропускании электрического тока атомы восстанавливают начальную полярность; 4. Химическое сродство пропорционально полярности веществ и температуре. Все элементы Берцелиус расположил в ряд по знаку и величине присущего их атомам заряда. В начале электрохимического ряда располагался абсолютно электроотрицательный кислород, далее – электроотрицательные элементы (неметаллы) и переходный (индифферентный) элемент водород (оксид которого – ни кислота, ни основание). За водородом следовали переменные (одни оксиды которых – кислоты, другие – основания) и электроположительные элементы (щелочные и щелочноземельные металлы). Кроме электрохимического ряда элементов, имелся и электрохимический ряд сложных атомов оксидов, в котором кислоты (кислотные оксиды по современной классификации) являлись электроотрицательными, а основания – электроположительными. Все химические реакции сводились, таким образом, к взаимодействию зарядов. Берцелиус писал: "Сернокислый натрий составлен не из серы, кислорода и натрия, а из серной кислоты и натра, которые, в свою очередь, могут быть разделены на электроположительную и электротрицательную части". Учитывая, что под термином "серная кислота" Берцелиус, в соответствие с теорией кислот Лавуазье, подразумевает оксид серы SO3, образование сульфата натрия можно описать следующей схемой: Для объяснения образования гидратных соединений Берцелиус предполагал, что вода может быть либо электроположительной, либо электроотрицательной частью соединения: Несмотря на присущие недостатки, дуалистическая теория Берцелиуса (кстати, очень хорошо согласующаяся с представлениями Лавуазье о природе солей, кислот и оснований) весьма удачно объясняла многие реакции между неорганическими веществами. Положение о том, что молекула химического соединения построена из радикалов, способных к самостоятельному существованию, оказало существенное влияние на развитие теорий структурной химии. Отголоски электрохимических представлений Берцелиуса нетрудно найти в современной теоретической неорганической химии (электроотрицательность, поляризуемость и поляризующее действие ионов и т.п.). В XIX веке система Берцелиуса несколько десятилетий представляла собой одну из теоретических основ химии. |
|||||||||||||||||||||||||||||||||||||||||||||||||||