|
Кафедра физической и коллоидной химии ЮФУ Материалы к лекциям для студентов химфака Давление насыщенного пара растворов. Закон Рауля Представим, что в равновесную систему жидкость А – пар введено некоторое вещество В. При образовании раствора мольная доля растворителя XА становится меньше единицы; равновесие в соответствии с принципом Ле Шателье – Брауна смещается в сторону конденсации вещества А, т.е. в сторону уменьшения давления насыщенного пара РА. Очевидно, что, чем меньше мольная доля компонента А в растворе, тем меньше парциальное давление его насыщенных паров над раствором. Для некоторых растворов выполняется следующая закономерность, называемая первым законом Рауля: Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причем коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Поскольку сумма мольных долей всех компонентов раствора равна единице, для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) легко получить следующее соотношение, также являющееся формулировкой первого закона Рауля:
Относительное понижение парциального давления пара растворителя над раствором равно мольной доле растворенного вещества и не зависит от природы растворенного вещества. Первый закон Рауля нетрудно вывести, используя понятие химического потенциала компонента, если считать пар над раствором идеальным газом. Условием гетерогенного равновесия является равенство химических потенциалов компонентов системы во всех фазах. Химический потенциал растворителя в растворе μА(р) связан с мольной долей растворителя в растворе XА уравнением (3):
Химический потенциал растворителя в паре μА(п) можно выразить через парциальное давление пара растворителя РА:
Химический потенциал чистого жидкого растворителя μ*А равен химическому потенциалу равновесного пара:
В состоянии равновесия μА(п) = μА(р). Комбинируя выражения (3-5), легко получить:
Принимая, что μ*А = μ°А(р), получаем следующее уравнение:
Отсюда легко получить выражение для первого закона Рауля:
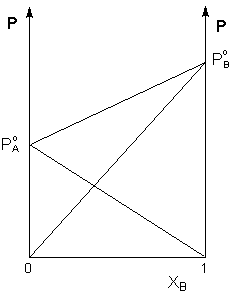
Растворы, для которых выполняется первый закон Рауля, называют идеальными растворами. Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам (оптические изомеры, гомологи и т.п.) и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором. Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области бесконечно малых концентраций. Если компоненты бинарного раствора летучи, то пар над раствором будет содержать оба компонента (относительное содержание компонентов в парах будет, как правило, отличаться от содержания их в растворе: пар относительно богаче компонентом, температура кипения которого ниже – см. следующий параграф). Рассмотрим идеальный бинарный раствор, состоящий из компонентов А и В, неограниченно растворимых друг в друге. Общее давление пара, согласно первому закону Рауля, равно
Таким
образом, для идеальных бинарных
растворов зависимость общего и
парциального давления насыщенного пара
от состава раствора, выраженного в
мольных долях компонента В, является
линейной при любых концентрациях (рисунок
1). К таким системам относятся, например,
системы бензол – толуол, гексан – гептан, смеси других изомерных
углеводородов. Для
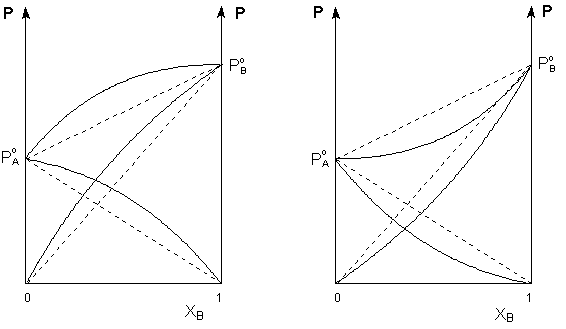
реальных растворов данные зависимости
являются криволинейными (рисунок 2).
Рис.
1. Зависимость парциальных и общего
давлений пара идеального раствора от
концентрации.
Рис.
2. Зависимость парциальных и общего
давлений пара идеальных (штриховая
линия) и реальных (сплошная линия)
бинарных растворов от состава при
положительных (слева) и отрицательных (справа)
отклонениях от закона Рауля. Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения). Образование реальных растворов сопровождается тепловым и объёмным (т.н. контракция) эффектами. Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0); объём раствора оказывается больше, чем сумма исходным объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств < 0) ); объём раствора в этом случае будет меньше, чем сумма исходным объёмов компонентов (ΔV < 0). |