|
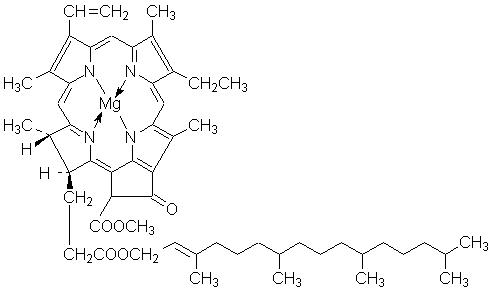
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ Конспект лекций для студентов биофака ЮФУ (РГУ) 2.2 ФОТОХИМИЧЕСКИЕ РЕАКЦИИ Передача энергии для активации вступающих во взаимодействие молекул может осуществляться либо в форме теплоты (т. н. темновые реакции), либо в виде квантов электромагнитного излучения. Реакции, в которых активация частиц является результатом их взаимодействия с квантами электромагнитного излучения видимой области спектра, называют фотохимическими реакциями. При всех фотохимических процессах выполняется закон Гротгуса: Химическое превращение вещества может вызвать только то излучение, которое поглощается этим веществом. Излучение, отражённое веществом, а также прошедшее сквозь него, не вызывают никаких химических превращений. Иногда фотохимические процессы происходят под действием излучения, которое не поглощается реагирующими веществами; однако в таких случаях реакционная смесь должна содержать т.н. сенсибилизаторы. Механизм действия сенсибилизаторов заключается в том, что они поглощают свет, переходя в возбуждённое состояние, а затем при столкновении с молекулами реагентов передают им избыток своей энергии. Сенсибилизатором фотохимических реакций является, например, хлорофилл (см. ниже). Взаимодействие света с веществом может идти по трём возможным направлениям: 1. Возбуждение частиц (переход электронов на вышележащие орбитали): A + hν ––> A* 2. Ионизация частиц за счет отрыва электронов: A + hν ––> A+ + e– 3. Диссоциация молекул с образованием свободных радикалов (гомолитическая) либо ионов (гетеролитическая): AB + hν ––> A• + B• AB + hν ––> A+ + B– Между количеством лучистой энергии, поглощенной молекулами вещества, и количеством фотохимически прореагировавших молекул существует соотношение, выражаемое законом фотохимической эквивалентности Штарка-Эйнштейна: Число молекул, подвергшихся первичному фотохимическому превращению, равно числу поглощенных веществом квантов электромагнитного излучения. Поскольку фотохимическая реакция, как правило, включает в себя и т.н. вторичные процессы (например, в случае цепного механизма), для описания реакции вводится понятие квантовый выход фотохимической реакции: Квантовый выход фотохимической реакции γ есть отношение числа частиц, претерпевших превращение, к числу поглощенных веществом квантов света. Квантовый выход реакции может варьироваться в очень широких пределах: от 10-3 (фотохимическое разложение метилбромида) до 106 (цепная реакция водорода с хлором); в общем случае, чем более долгоживущей является активная частица, тем с большим квантовым выходом протекает фотохимическая реакция. Важнейшими фотохимическими реакциями являются реакции фотосинтеза, протекающие в растениях с участием хлорофилла:
Процесс фотосинтеза составляют две стадии: световая, связанная с поглощением фотонов, и значительно более медленная темновая, представляющая собой ряд химических превращений, осуществляемых в отсутствие света. Суммарный процесс фотосинтеза заключается в окислении воды до кислорода и восстановлении диоксида углерода до углеводов: СО2 + Н2О + hν ––> (СН2О) + О2, ΔG° = 477.0 кДж/моль Протекание данного окислительно-восстановительного процесса (связанного с переносом электронов) возможно благодаря наличию в реакционном центре хлорофилла Сhl донора D и акцептора A электронов; перенос электронов происходит в результате фотовозбуждения молекулы хлорофилла: DChlA + hν ––> DChl*A ––> DChl+A– ––> D+ChlA– Возникающие в данном процессе заряженные частицы D+ и A– принимают участие в дальнейших окислительно-восстановительных реакциях темновой стадии фотосинтеза. |